La structure du complexe NuA4/Tip60 révèle le mécanisme et l'importance de modifier la chromatine à longue distance
L’acétylation des histones facilite la transcription des gènes et la réparation de l'ADN et est réalisée par divers complexes multiprotéiques. Parmi eux, le complexe NuA4 dispose de la capacité remarquable d'acétyler ses cibles à distance de son site de recrutement. Dans un article publié dans Nature Structural and Molecular Biology, les scientifiques élucident la structure de ce complexe, la façon dont il agit à distance de son site de liaison et la pertinence de cette activité à longue portée.
L'ADN, porteur de l'information génétique, s'enroule autour des protéines histones pour former la structure répétée du nucléosome. Certaines régions de l'ADN doivent être accessibles pour l'expression des gènes ou la réparation des dommages. C'est pourquoi les nucléosomes situés à proximité de ces sites d'ADN sont généralement modifiés par acétylation, ce qui crée une forme décondensée de l'ADN, plus accessible.
Dans la levure boulangère, la seule enzyme histone acétylase essentielle est incorporée dans le complexe protéique NuA4. Il est intéressant de noter que le recrutement local de NuA4 se traduit par des profils d'acétylation s'étendant sur plusieurs nucléosomes à des distances dix fois supérieures à la taille attendue de NuA4.
NuA4 est constitué de quatre modules reliés entre eux par la sous-unité Eaf1, qui joue le rôle d'échafaudage, mais on dispose de peu d'informations structurelles sur ce complexe.
Plusieurs questions fondamentales restent sans réponse, notamment celle de savoir comment l'activité histone acétylase est intégrée dans le complexe et comment elle cible les nucléosomes situés à une grande distance. D'autres structures de modification de la chromatine sont également soupçonnés de posséder une activité à longue distance, mais le mécanisme et la pertinence fonctionnelle d'une telle activité restent insaisissables.
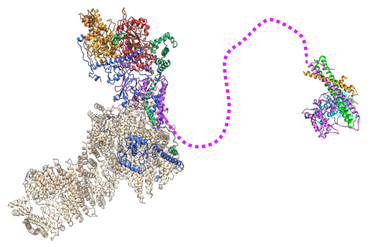
Dans cette étude, les scientifiques ont réussi à déterminer la structure à un niveau de résolution atomique de NuA4. Un échafaudage composé de trois sous-unités entrelacées, dont une protéine appelée Ep11, relie les différents modules de NuA4 et intègre le module d'acétylation des histones. Fait important, la structure a révélé qu'une longue région non structurée de la protéine Epl1 relie le cœur de NuA4 au module d'acétylation. Ce lien flexible confère au module enzymatique son action à longue portée par rapport au noyau de NuA4, une capacité essentielle à la prolifération de la levure, comme l'ont démontré les auteurs. Ils ont également montré une réduction des niveaux d'acétylation de H4 sur de très grandes régions génomiques, couvrant plusieurs milliers de paires de bases, lorsque la région non structurée d'Epl1 est raccourcie.
Ceci démontre son importance dans l'établissement de l'acétylation des nucléosomes sur de longues distances, ce qui est crucial pour le bon fonctionnement de la prolifération de la levure.

Structure par cryomicroscopie électronique du cœur du complexe NuA4. Le module d’acétylation est connecté par un lien flexible à la sous-unité Epl1.
Crédit : Alexandre Frechard, IBMC
