Différenciation et physiopathologie des cellules endocrines pancréatiques et intestinales
Différenciation et physiopathologie des cellules endocrines pancréatiques et intestinales
Notre objectif principal est d’élucider les réseaux de régulation transcriptionelle qui contrôlent la différenciation, la fonction et le maintien de l’identité des cellules endocrines du pancréas et de l’intestin et d’étudier leurs dysfonctionnements dans les maladies métaboliques comme le diabète.
Les stratégies futures de thérapie cellulaire et de médecine régénérative dépendent fortement de la connaissance détaillée des mécanismes de différenciation des cellules souches multipotentes en cellules hautement spécialisées. Dans ce contexte, notre but est de comprendre comment les cellules endocrines du pancréas et de l’intestin sont générées à partir des cellules souches/progénitrices durant l’embryogénèse et jusqu’à la vie adulte.
Les cellules endocrines pancréatiques sont regroupées en îlots au sein du tissu exocrine. Ces îlots comprennent cinq types de cellules endocrines produisant des hormones différentes, dont les cellules bêta sécrétrices d'insuline. Ces hormones contrôlent de concert l’homéostasie du glucose. La destruction des cellules bêta ou leur dysfonctionnement conduit au diabète. Les cellules endocrines intestinales, également appelées cellules entéroendocrines (CEE), sont très étroitement liées aux cellules endocrines pancréatiques en ce qui concerne leur origine embryonnaire, leurs programmes de différenciation et leurs rôles physiologiques dans le contrôle de l'homéostasie énergétique. Les CEEs sont des cellules rares de la muqueuse intestinale, elles détectent les nutriments dans la lumière intestinale et, en réponse, sécrètent une variété d'hormones qui agissent localement ou à distance pour réguler l'homéostasie énergétique via leur contrôle de l'absorption intestinale, de la prise alimentaire et de la sécrétion d'insuline. Nous avons montré précédemment, qu’à la fois dans le pancréas et l’intestin, l’ensemble des cellules endocrines dérivent de cellules progénitrices exprimant le facteur de transcription pro-endocrinien Neurog3. En l'absence de Neurog3, les cellules des îlots de Langerhans et les CEEs ne se forment pas, entraînant un diabète néonatal et une malabsorption intestinale chez la souris et l'homme. Malgré la fonction essentielle de ce facteur de transcription et l'identification de quelques gène cibles de Neurog3, les mécanismes moléculaires mettant en œuvre la fonction endocrinogénique de Neurog3 sont mal compris.
Dans ce contexte, nous nous concentrons sur l'identification et l'étude de nouveaux gènes contrôlant la spécification et la spécialisation des sous-types cellulaires endocrines et leur maturation fonctionnelle. Pour répondre à ces questions, nous utilisons des systèmes de culture d'organoïdes humains dérivés de cellules souches et des modèles murins combinés à des approches de perte de fonction et multi-omiques. Nous espérons que nos études contribueront au développement d'une thérapie cellulaire du diabète, ainsi qu'à comprendre les mécanismes sous-jacents des insuffisances endocriniennes pancréatiques et intestinales chez l'homme.

Membres
Chercheur(euse)s
Doctorant(e)s
Technicien(ne)s
Financements et partenaires
L’équipe a été soutenue par des financements de
- Novonordisk Foundation
- Agence National pour la Recherche (ANR)
- Fondation pour la Recherche Médicale (FRM)
- Novonordisk
- National Institute for Diabetes and Digestive and Kidney Disease (NIDDK)
- Société Française des Diabétiques (SFD)
- Juvenile Diabetes Research Foundation (JDRF)
- Union Européenne (6th FP)
- Institut Benjamin Delessert
- Association Française des Diabétiques (AFD)
- Université de Strasbourg
- ARC
- INSERM-AVENIR
Actualités
FateCompass : identifier et prédire les critères décisifs du destin cellulaire
La différenciation cellulaire est un processus régulé par l’expression des gènes grâce à l’action de facteurs de transcription. Différents facteurs de…
Lire la suite
Ressources
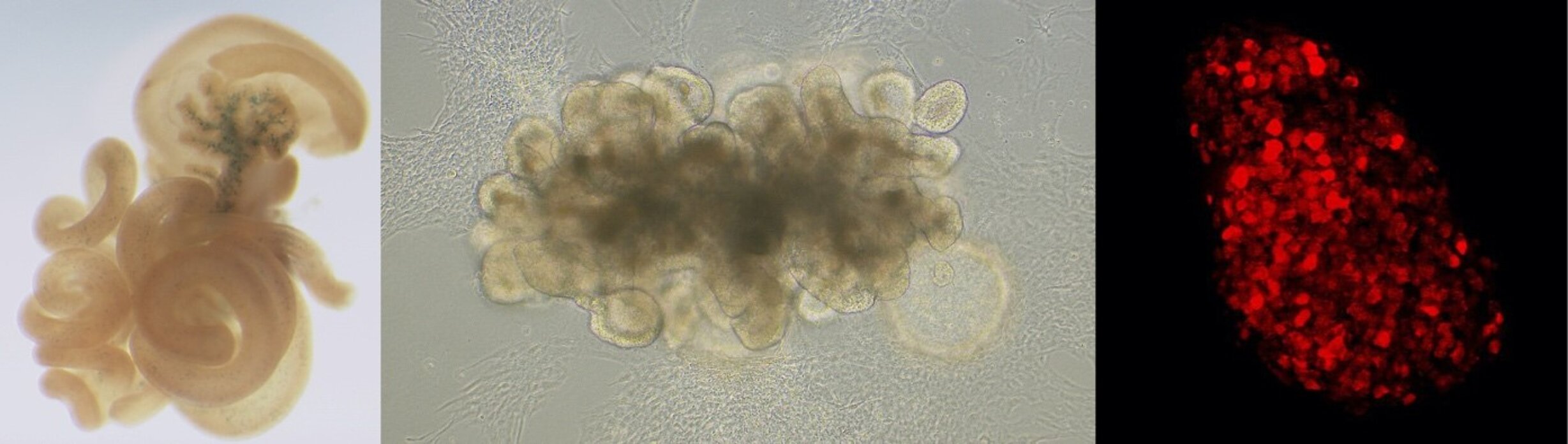
Organoïde intestinal humain. Les progéniteurs entéroendocrines expriment le facteur de transcription NEUROG3 (rouge).
Publications
2025
Article dans une revue
Extracellular matrix-driven metabolic control of pancreatic endocrine lineage allocation
- Christine Ebeid
- Adam Rump
- Chenglei Tian
- Anant Mamidi
- Adèle de Arcangelis
- Gérard Gradwohl
- Henrik Semb
EMBO Reports ; Page: Online ahead of print
Article dans une revue
Unraveling enteroendocrine cell lineage dynamics and associated gene regulatory networks during intestinal development
- Sara Jiménez
- Florence Blot
- Aline Meunier
- Rishabh Kapoor
- Valérie Schreiber
- Colette Giethlen
- Sabitri Ghimire
- Maxime Mahe
- Nacho Molina
- Adèle de Arcangelis
- Gérard Gradwohl
Biology Open ; Volume: 14 ; Page: bio062083
2023
Article dans une revue
An Efficient Protocol for CUT&RUN Analysis of FACS-Isolated Mouse Satellite Cells
- Kamar Ghaibour
- Joe Rizk
- Claudine Ebel
- Tao Ye
- Muriel Philipps
- Valérie Schreiber
- Daniel Metzger
- Delphine Duteil
Journal of visualized experiments : JoVE ; Volume: 197 ; Page: 1-21
Article dans une revue » Data paper
Characterization of cell-fate decision landscapes by estimating transcription factor dynamics
- Sara Jiménez
- Valérie Schreiber
- Reuben Mercier
- Gérard Gradwohl
- Nacho Molina
Cell Reports Methods ; Page: 100512
Article dans une revue
Poly(ADP-ribose) polymerase 9 mediates early protection against Mycobacterium tuberculosis infection by regulating type I IFN production
- Shyamala Thirunavukkarasu
- Mushtaq Ahmed
- Bruce A Rosa
- Mark Boothby
- Sung Hoon Cho
- Javier Rangel-Moreno
- Stanley K Mbandi
- Valérie Schreiber
- Ananya Gupta
- Joaquin Zuniga
- Makedonka Mitreva
- Deepak Kaushal
- Thomas J Scriba
- Shabaana A Khader
The Journal of clinical investigation ; Volume: 133
Article dans une revue
De la biologie du développement à la thérapie cellulaire du diabète
- Valérie Schreiber
- Gérard Gradwohl
Médecine des Maladies Métaboliques
Article dans une revue
Gut microbiota remodeling and intestinal adaptation to lipid malabsorption after enteroendocrine cell loss in adult mice
- Florence Blot
- Justine Marchix
- Miriam Ejarque
- Sara Jimenez
- Aline Meunier
- Céline Keime
- Camille Trottier
- Mikaël Croyal
- Céline Lapp
- Maxime Mahe
- Adèle de Arcangelis
- Gérard Gradwohl
Cellular and Molecular Gastroenterology and Hepatology
2021
Article dans une revue
The laminin-binding integrins regulate nuclear factor kappaB-dependent epithelial cell polarity and inflammation
- Eugenia M. Yazlovitskaya
- Erin Plosa
- Fabian Bock
- Olga M. Viquez
- Glenda Mernaugh
- Leslie S. Gewin
- Adele de Arcangelis
- Elisabeth Georges-Labouesse
- Arnoud Sonnenberg
- Timothy S. Blackwell
- Ambra Pozzi
- Roy Zent
Journal of Cell Science ; Volume: 134
Article dans une revue
Extensive NEUROG3 occupancy in the human pancreatic endocrine gene regulatory network
- Valérie Schreiber
- Reuben Mercier
- Sara Jiménez
- Tao Ye
- Emmanuel García-Sánchez
- Annabelle Klein
- Aline Meunier
- Sabitri Ghimire
- Catherine Birck
- Bernard Jost
- Kristian Honnens de Lichtenberg
- Christian Honoré
- Palle Serup
- Gérard Gradwohl
Molecular metabolism ; Volume: 53 ; Page: 101313
Article dans une revue
Adhesion receptor ADGRG2/GPR64 is in the GI-tract selectively expressed in mature intestinal tuft cells
- Kaare V. Grunddal
- Sarah Tonack
- Kristoffer L. Egerod
- Jonanthan James Thompson
- Natalia Petersen
- Maja S. Engelstoft
- Constance Vagne
- Céline Keime
- Gerard Gradwohl
- Stefan Offermanns
- Thue W. Schwartz
Molecular metabolism ; Volume: 51
Page 1 sur 9

