Différenciation et physiopathologie des cellules endocrines pancréatiques et intestinales
Différenciation et physiopathologie des cellules endocrines pancréatiques et intestinales
Notre objectif principal est d’élucider les réseaux de régulation transcriptionelle qui contrôlent la différenciation, la fonction et le maintien de l’identité des cellules endocrines du pancréas et de l’intestin et d’étudier leurs dysfonctionnements dans les maladies métaboliques comme le diabète.
Les stratégies futures de thérapie cellulaire et de médecine régénérative dépendent fortement de la connaissance détaillée des mécanismes de différenciation des cellules souches multipotentes en cellules hautement spécialisées. Dans ce contexte, notre but est de comprendre comment les cellules endocrines du pancréas et de l’intestin sont générées à partir des cellules souches/progénitrices durant l’embryogénèse et jusqu’à la vie adulte.
Les cellules endocrines pancréatiques sont regroupées en îlots au sein du tissu exocrine. Ces îlots comprennent cinq types de cellules endocrines produisant des hormones différentes, dont les cellules bêta sécrétrices d'insuline. Ces hormones contrôlent de concert l’homéostasie du glucose. La destruction des cellules bêta ou leur dysfonctionnement conduit au diabète. Les cellules endocrines intestinales, également appelées cellules entéroendocrines (CEE), sont très étroitement liées aux cellules endocrines pancréatiques en ce qui concerne leur origine embryonnaire, leurs programmes de différenciation et leurs rôles physiologiques dans le contrôle de l'homéostasie énergétique. Les CEEs sont des cellules rares de la muqueuse intestinale, elles détectent les nutriments dans la lumière intestinale et, en réponse, sécrètent une variété d'hormones qui agissent localement ou à distance pour réguler l'homéostasie énergétique via leur contrôle de l'absorption intestinale, de la prise alimentaire et de la sécrétion d'insuline. Nous avons montré précédemment, qu’à la fois dans le pancréas et l’intestin, l’ensemble des cellules endocrines dérivent de cellules progénitrices exprimant le facteur de transcription pro-endocrinien Neurog3. En l'absence de Neurog3, les cellules des îlots de Langerhans et les CEEs ne se forment pas, entraînant un diabète néonatal et une malabsorption intestinale chez la souris et l'homme. Malgré la fonction essentielle de ce facteur de transcription et l'identification de quelques gène cibles de Neurog3, les mécanismes moléculaires mettant en œuvre la fonction endocrinogénique de Neurog3 sont mal compris.
Dans ce contexte, nous nous concentrons sur l'identification et l'étude de nouveaux gènes contrôlant la spécification et la spécialisation des sous-types cellulaires endocrines et leur maturation fonctionnelle. Pour répondre à ces questions, nous utilisons des systèmes de culture d'organoïdes humains dérivés de cellules souches et des modèles murins combinés à des approches de perte de fonction et multi-omiques. Nous espérons que nos études contribueront au développement d'une thérapie cellulaire du diabète, ainsi qu'à comprendre les mécanismes sous-jacents des insuffisances endocriniennes pancréatiques et intestinales chez l'homme.
.png)
Membres
Chercheur(euse)s
Doctorant(e)s
Technicien(ne)s
Financements et partenaires
L’équipe a été soutenue par des financements de
- Novonordisk Foundation
- Agence National pour la Recherche (ANR)
- Fondation pour la Recherche Médicale (FRM)
- Novonordisk
- National Institute for Diabetes and Digestive and Kidney Disease (NIDDK)
- Société Française des Diabétiques (SFD)
- Juvenile Diabetes Research Foundation (JDRF)
- Union Européenne (6th FP)
- Institut Benjamin Delessert
- Association Française des Diabétiques (AFD)
- Université de Strasbourg
- ARC
- INSERM-AVENIR
Actualités
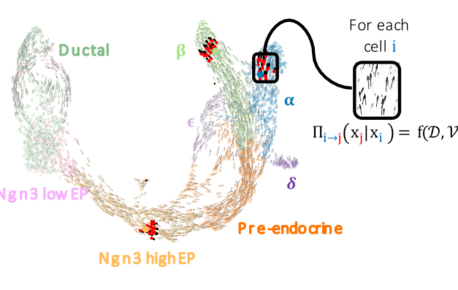
FateCompass : identifier et prédire les critères décisifs du destin cellulaire
La différenciation cellulaire est un processus régulé par l’expression des gènes grâce à l’action de facteurs de transcription. Différents facteurs de…
Lire la suite
Ressources
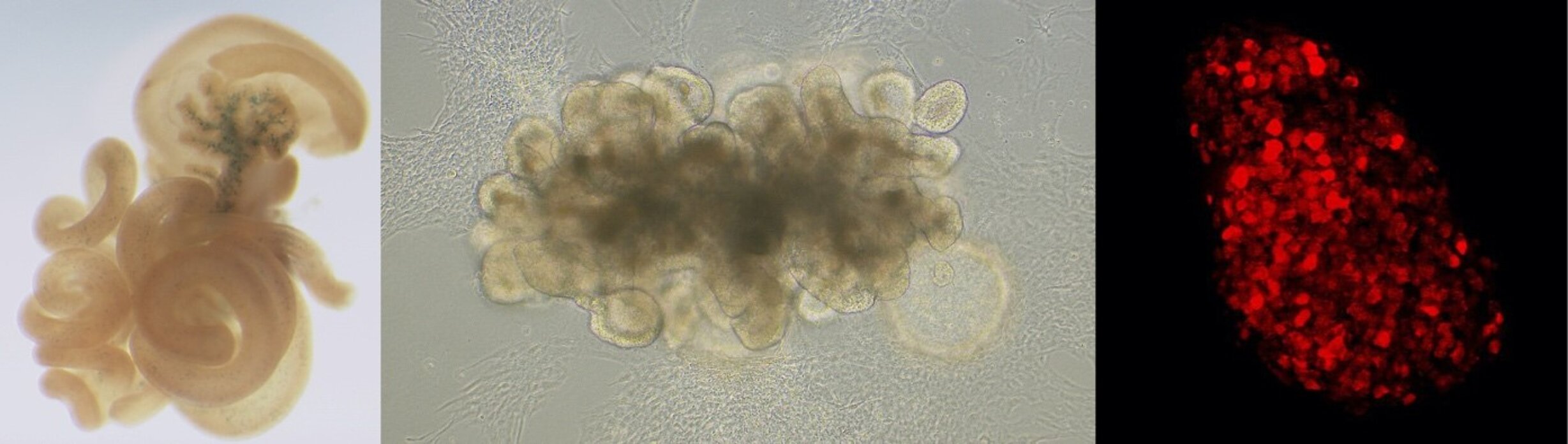
Organoïde intestinal humain. Les progéniteurs entéroendocrines expriment le facteur de transcription NEUROG3 (rouge).
Publications
-
2011
-
Differential requirements for neurogenin 3 in the development of POMC and NPY neurons in the hypothalamus
- Michelle Pelling
- Neal Anthwal
- David Mcnay
- Gerard Gradwohl
- Andrew Leiter
- Francois Guillemot
- Siew-Lan Ang
Developmental Biology ; Volume: 349 ; Page: 406-416
-
-
2010
-
Rfx6 is an Ngn3-dependent winged helix transcription factor required for pancreatic islet cell development
- Josselin Soyer
- Lydie Flasse
- Wolfgang Raffelsberger
- Anthony Beucher
- Christophe Orvain
- Bernard Peers
- Philippe Ravassard
- Julien Vermot
- Marianne L. Voz
- Georg Mellitzer
- Gerard Gradwohl
Development: For advances in developmental biology and stem cells ; Volume: 137 ; Page: 203-212
-
Loss of enteroendocrine cells in mice alters lipid absorption and glucose homeostasis and impairs postnatal survival
- Georg Mellitzer
- Anthony Beucher
- Viviane Lobstein
- Pascal Michel
- Sylvie Robine
- Michèle Kedinger
- Gérard Gradwohl
Journal of Clinical Investigation ; Volume: 120 ; Page: 1708-1721
-
Expression of neuropeptide Y and agouti-related peptide in the hypothalamic arcuate nucleus of newborn neurogenin3 null mutant mice
- Yuta Arai
- Gerard Gradwohl
- Yoko Kameda
Cell and Tissue Research ; Volume: 340 ; Page: 137-145
-
-
2008
-
Transcription factor PROX1 induces colon cancer progression by promoting the transition from benign to highly dysplastic phenotype.
- Tatiana V Petrova
- Antti Nykänen
- Camilla Norrmén
- Konstantin I Ivanov
- Leif C Andersson
- Caj Haglund
- Pauli Puolakkainen
- Frank Wempe
- Harald von Melchner
- Gérard Gradwohl
- Sakari Vanharanta
- Lauri A Aaltonen
- Juha Saharinen
- Massimiliano Gentile
- Alan Clarke
- Jussi Taipale
- Guillermo Oliver
- Kari Alitalo
Cancer Cell ; Volume: 13 ; Page: 407-19
-
Characterization of the proneural gene regulatory network during mouse telencephalon development
- Julia M. Gohlke
- Olivier Armant
- Frederick M. Parham
- Marjolein V. Smith
- Celine Zimmer
- Diogo S. Castro
- Laurent Nguyen
- Joel S. Parker
- Gerard Gradwohl
- Christopher J. Portier
- François Guillemot
BMC Biology ; Volume: 6
-
GeneSpeed Beta Cell: an online genomics data repository and analysis resource tailored for the islet cell biologist
- Nayeem Quayum
- Alecksandr Kutchma
- Suparna A. Sarkar
- Kirstine Juhl
- Gerard Gradwohl
- Georg Mellitzer
- John C. Hutton
- Jan Jensen
Experimental Diabetes Research ; Volume: 2008
-
-
2007
-
Temporal Control of Neurogenin3 Activity in Pancreas Progenitors Reveals Competence Windows for the Generation of Different Endocrine Cell Types
- Kerstin Johansson
- Umut Dursun
- Nathalie Jordan
- Guoqiang Gu
- Friedrich Beermann
- Gérard Gradwohl
- Anne Grapin-Botton
Developmental Cell ; Volume: 12 ; Page: 457-465
-
-
2005
-
Genetic determinants of pancreatic epsilon-cell development.
- R Scott Heller
- Marjorie Jenny
- Patrick Collombat
- Ahmed Mansouri
- Catherine Tomasetto
- Ole D Madsen
- Georg Mellitzer
- Gerard Gradwohl
- Palle Serup
Developmental Biology ; Volume: 286 ; Page: 217-24
-
Dorsal pancreas agenesis in retinoic acid-deficient Raldh2 mutant mice.
- Mercè Martín
- Jabier Gallego-Llamas
- Vanessa Ribes
- Michèle Kedinger
- Karen Niederreither
- Pierre Chambon
- Pascal Dollé
- Gérard Gradwohl
Developmental Biology ; Volume: 284 ; Page: 399-411
-
Page 3 sur 4

