RESPONSABLE DE SOUS-GROUPE

Michel ROUX
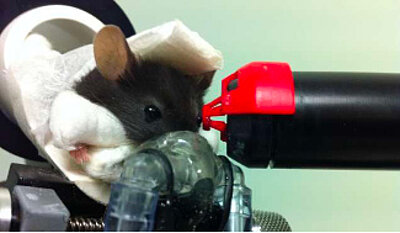 Une technique non invasive pour examiner la rétine de souris : la tomographie par cohérence optique
Une technique non invasive pour examiner la rétine de souris : la tomographie par cohérence optique
Les troubles visuels affectant les patients atteints de déficience intellectuelle (DI) et/ou de troubles du spectre autistique (TSA) attirent rarement l’attention, car mineurs par rapport aux autres symptômes. Cependant, des anomalies fonctionnelles et/ou anatomiques (altération de la perception des contrastes et/ou des couleurs, changement dans l’épaisseur de tout ou partie de la rétine) sont de plus en plus fréquemment rapportées dans de nombreuses maladies du système nerveux central (SNC), comme Alzheimer, Parkinson ou trisomie 21. On peut notamment souligner la détection de plaques amyloïdes dans les rétines des patients Alzheimer, en corrélation avec la gravité des symptômes cognitifs (revue dans Mirzaei et al., 2020), une diminution de la concentration de dopamine les patients atteints de la maladie de Parkinson (Harnois et Di Paolo, 1990), ou encore un épaississement de la rétine interne chez les sujets atteints de trisomie 21 (Laguna et al., 2013; O’Brien et al., 2015). Issue du diencéphale, la rétine est facilement observable in vivo, avec une précision de quelques microns grâce aux développements de techniques comme la tomographie par cohérence optique (OCT). Elle possède de plus une structure en couches bien déterminées, avec une distribution régulière des nombreux types neuronaux bien caractérisés, à travers la combinaison de marqueurs moléculaires, de critères morphologiques et de réponses à des stimuli lumineux (Masland, 2001, 2012; Vlasits et al., 2019) . Ce sont autant d’avantages pour comprendre les perturbations neuronales induites par les anomalies génétiques associées à une DI et/ou des TSA. A l’aide de différents modèles animaux (souris ou rats) de ces maladies, nous cherchons à caractériser ces perturbations, identifier les mécanismes moléculaires impliqués et mesurer l’efficacité de traitements en cours de développement. Au-delà des connaissances sur la physiopathologie rétinienne, cette approche devrait également nous éclairer pour comprendre ce qui se passe au niveau des structures centrales. De par leur étroite parenté développementale, nous nous concentrons sur les parallèles entre rétine et noyaux du diencéphale, comme l’habenula et le noyau paraventriculaire de l’hypothalamus, dont l’implication dans les symptômes de la trisomie 21 reste à étudier, malgré des rôles dans la prise de décision et les comportements alimentaires.
Ce projet fait intervenir une variété de techniques, de l’in vivo (fond d’œil, tomographie par cohérence optique) au moléculaire (RNAseq), en passant par l’immunohistologie et l’électrophysiologie (patch-clamp, multi-electrode array) sur rétine et cerveau.


 Une technique non invasive pour examiner la rétine de souris : la tomographie par cohérence optique
Une technique non invasive pour examiner la rétine de souris : la tomographie par cohérence optique