Chromatine et régulation épigénétique
Chromatine et régulation épigénétique
La principale activité de recherche de notre groupe est d’étudier le rôle des histones variantes et de leur mécanisme de déposition dans le contrôle épigénétique de l'activité du génome humain, au niveau du génome complet. Parmi les divers mécanismes de mémoire épigénétique, le remplacement local d’histones canoniques au sein du nucléosome par des histones variantes a le potentiel d’affecter considérablement l’activité des régions génomiques correspondantes.
En effet, les nucléosomes porteurs d’histones variantes ont une structure et des activités fonctionnelles distinctes in vitro, et certaines histones variantes sont incorporées à des emplacements spécifiques dans le génome.
Notre laboratoire concentre ses efforts sur le rôle des histones variantes dans la régulation génique et le maintien de l'intégrité du génome. Nous avons récemment impliqué la variante macroH2A dans la régulation de la transcription et l’activité enzymatique de PARP-1 (Ouararhni et al., 2006), et nous avons découvert un nouveau lien entre les histones variantes, les facteurs de transcription et l’ARN non codant (résultats non publiés).
Cette association avec les facteurs de transcription et l’ARN non codant est une nouveauté, et nous aidera certainement à comprendre comment sont établis les domaines de la chromatine et comment l’information épigénétique est conservée et transmise aux cellules filles. L'altération de ces marques épigénétiques est associée à des troubles du développement et des cancers.
Membres
Chercheur(euse)s
Post-doctorant(e)s
Doctorant(e)s
Ingénieur(eure)s
Technicien(ne)s
Actualités
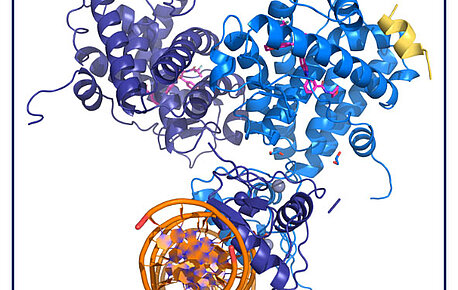
La structure quaternaire du GR met en lumière la communication allostérique inter-domaine
Dans le cas de maladies inflammatoires ou auto-immunes, moduler l’action du récepteur des glucocorticoïdes (GR) est une stratégie thérapeutique…
Lire la suite
Publications
2026
Pré-publication, Document de travail
A Rahman Syndrome mutation in histone H1.4 disrupts chromatin compaction and phase separation
- Carlo Petosa
- Ramachandran Boopathi
- Isabel Garcia-Saez
- Imtiaz Nisar Lone
- Abed Alkarem Abu Alhaija
- Jeffrey J. Hayes
- Jan Bednar
- Muhammed Kasim Diril
- Aline Le Roy
- Dimitrios Skoufias
- Ali Hamiche
- Seyit Kale
- Stefan Dimitrov
- Dimitar Angelov
- Serhan Turunc
- Ashok Kumar
- Dimitar Iliev
- Anastas Gospodinov
2024
Article dans une revue
Identification of a novel DNA oxidative damage repair pathway, requiring the ubiquitination of the histone variant macroH2A1.1
- Khalid Ouararhni
- Flore Mietton
- Jamal Sabir
- Abdulkhaleg Ibrahim
- Annie Molla
- Raed Albheyri
- Ali Zari
- Ahmed Bahieldin
- Hervé Menoni
- Christian Bronner
- Stefan Dimitrov
- Ali Hamiche
BMC Biology ; Volume: 22 ; Page: 188
Article dans une revue
UHRF1 poly-auto-ubiquitination induced by the anti-cancer drug, thymoquinone, is involved in the DNA repair machinery recruitment.
- Naif A.R. Almalki
- Jamal S.M. Sabir
- Abdulkhaleg Ibrahim
- Mahmoud Alhosin
- Amer Asseri
- Raed Albiheyri
- Ali Zari
- Ahmed Bahieldin
- Aqib Javed
- Yves Mély
- Ali Hamiche
- Marc Mousli
- Christian Bronner
International Journal of Biochemistry and Cell Biology ; Volume: 171 ; Page: 106582
Article dans une revue
H2A.Z is involved in premature aging and DSB repair initiation in muscle fibers
- Edwige Belotti
- Nicolas Lacoste
- Arslan Iftikhar
- Thomas Simonet
- Christophe Papin
- Alexis Osseni
- Nathalie Streichenberger
- Pierre-Olivier Mari
- Emmanuelle Girard
- Mohamed Graies
- Giuseppina Giglia-Mari
- Stefan Dimitrov
- Ali Hamiche
- Laurent Schaeffer
Nucleic Acids Research ; Volume: 52 ; Page: 3031-3049
Article dans une revue
Identification and Characterization of HIRIP3 as a Histone H2A Chaperone
- Maria Ignatyeva
- Abdul Kareem Mohideen Patel
- Abdulkhaleg Ibrahim
- Raed Albiheyri
- Ali Zari
- Ahmed Bahieldin
- Christian Bronner
- Jamal Sabir
- Ali Hamiche
Cells ; Volume: 13 ; Page: 273
Article dans une revue
Development of a mouse embryonic stem cell model for investigating the functions of the linker histone H1 ‐4
- Abed Alkarem Abu Alhaija
- Imtiaz Nisar Lone
- Esin Ozkuru Sekeroglu
- Tugce Batur
- Dimitar Angelov
- Stefan Dimitrov
- Ali Hamiche
- Elif Nur Firat Karalar
- Muhammed Erdem Ercan
- Tamer Yagci
- Hani Alotaibi
- Muhammed Kasim Diril
FEBS Open Bio
2023
Article dans une revue
MBD4 loss results in global reactivation of promoters and retroelements with low methylated CpG density
- Christophe Papin
- Abdulkhaleg Ibrahim
- Jamal Sabir
- Stéphanie Le Gras
- Isabelle Stoll
- Raed Albiheyri
- Ali Zari
- Ahmed Bahieldin
- Alfonso Bellacosa
- Christian Bronner
- Ali Hamiche
Journal of experimental & clinical cancer research ; Volume: 42 ; Page: 301
Article dans une revue
The CENP-A nucleosome: where and when it happens during the inner kinetochore’s assembly
- Seyit Kale
- Ramachandran Boopathi
- Edwige Belotti
- Imtiaz Nisar Lone
- Mohamed Graies
- Maria Schröder
- Maria Petrova
- Christophe Papin
- Jan Bednar
- Iva Ugrinova
- Ali Hamiche
- Stefan Dimitrov
Trends in Biochemical Sciences ; Volume: 48 ; Page: 849-859
Article dans une revue
Asymmetric dimerization in a transcription factor superfamily is promoted by allosteric interactions with DNA
- Abdul Kareem Mohideen Patel
- Pierre Vilela
- Tajith Baba Shaik
- Alastair G Mcewen
- Isabelle Hazemann
- Karl Brillet
- Eric Ennifar
- Ali Hamiche
- Gabriel V Markov
- Vincent Laudet
- Dino Moras
- Bruno P Klaholz
- Isabelle M Billas
Nucleic Acids Research ; Volume: 51 ; Page: 8864-8879
Article dans une revue » Article de synthèse
Natural and Synthetic Anticancer Epidrugs Targeting the Epigenetic Integrator UHRF1
- Waseem Ashraf
- Tanveer Ahmad
- Nicolas Reynoird
- Ali Hamiche
- Yves Mély
- Christian Bronner
- Marc Mousli
Molecules ; Volume: 28 ; Page: 5997
Page 1 sur 9
