Oncogenèse et progression des cancers hormono-dépendants
Responsable de sous-groupe : Daniel METZGER
Équipe(s) : Rôles physiopathologiques des voies de signalisation des récepteurs nucléaires
Les hormones stéroïdes (e.g. androgènes, œstrogènes, corticoïdes) et sécostéroïdes (e.g. vitamine D) jouent un rôle clé dans la coordination du développement et de l’homéostasie chez les mammifères. L’activité de chaque hormone est relayée par des protéines appartenant à la famille multigénique des récepteurs nucléaires. Le couple hormone-récepteur fonctionne comme un système de clé-serrure très sélectif qui va moduler l’expression de nombreux gènes et les activités des cellules cibles.
Les androgènes et les œstrogènes sont essentiels à la maturation sexuelle, les corticoïdes sont impliqués dans le contrôle des activités circadiennes et les effets du stress, et la vitamine D régule les niveaux de calcium sanguins. De plus, de par leurs effets sur le métabolisme, la prolifération et l’inflammation, leurs récepteurs sont des cibles thérapeutiques pour des pathologies réfractaires aux traitements actuels, telles que des maladies auto-immunes, des maladies rares ou des cancers.
L’objectif du laboratoire est de mieux comprendre les effets de ces hormones en conditions physiologiques et physiopathologiques à l’échelle de l’organisme entier. Les résultats obtenus permettront de révéler les évènements moléculaires et cellulaires qui relayent l’activité de ces hormones, d’identifier de nouvelles cibles thérapeutiques pour de nombreuses pathologies dépourvues à ce jour de traitements efficaces.
Offre d'emploi : Chercheur post-doctoral.

Responsable de sous-groupe : Daniel METZGER
Équipe(s) : Rôles physiopathologiques des voies de signalisation des récepteurs nucléaires
Responsable de sous-groupe : Gilles LAVERNY
Équipe(s) : Rôles physiopathologiques des voies de signalisation des récepteurs nucléaires
Doctorants (depuis 2010)
Chercheurs Post-doctorants (depuis 2010) :
Ingénieurs (depuis 2010):
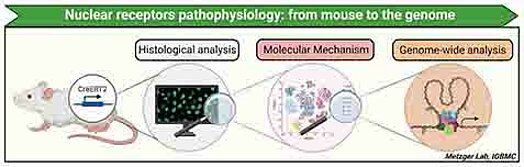
Stratégie générale
Les récepteurs nucléaires sont des facteurs de transcription qui relayent la signalisation hormonale en une réponse transcriptionnelle. L’activité d’environ 2/3 des 48 récepteurs nucléaires est contrôlée par des ligands (e.g. hormones stéroïdes, rétinoïdes, lipides intracellulaires), et est modulée par des corégulateurs transcriptionnels formant des complexes macromoléculaires qui activent (coactivateurs) ou répriment (corépresseurs) l’expression de gènes cibles en rendant l’ADN plus ou moins accessible à la machinerie transcriptionnelle. Ces caractéristiques font de ces facteurs de transcription des cibles thérapeutiques de choix.
Les différents projets du laboratoire visent à élucider les effets des hormones stéroïdes et de la vitamine D en conditions physiologiques et physiopathologiques à l’échelle de l’organisme, grâce aux techniques de mutagenèse somatique conditionnelle (CreERT2) développées au laboratoire. En utilisant une approche de biologie intégrative combinant des analyses phénotypiques et génomiques, nous caractérisons les modifications transcriptomiques (e.g. RNA-seq) et protéomiques (e.g. spectrométrie de masse), ainsi que l’organisation de la chromatine (e.g. ChIP-seq, ATAC-seq), dans des modèles murins reproduisant des pathologies humaines. En parallèle, nous développons des outils d’analyse de cellules uniques (e.g. cytométrie en flux, single cell RNA-seq, ATAC-seq, transcriptomique spatiale) visant à déterminer et caractériser les populations cellulaires impliquées dans la pathogénèse.
Retombés et impact
Les différentes collaborations et notre réseau d’experts facilitent la validation de nos résultats sur des échantillons humains, et permettront d’améliorer la compréhension des mécanismes sous-jacents à l’homéostasie cellulaire et d’identifier de nouvelles options thérapeutiques. De plus, une meilleure compréhension des activités sélectives de ces récepteurs dans un tissu donné permettra de faciliter la conception de nouveaux agents thérapeutiques dépourvus d’effets secondaires.
Publication récemment parue : doi.org/10.1038/s41419-025-07361-1
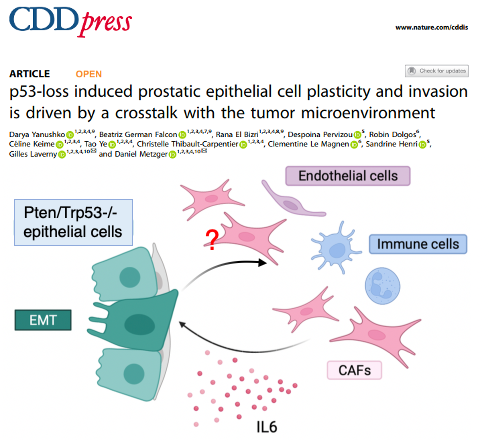
Pour visaliser nos analyses de single cell RNA seq : https://metzger-chambon.igbmc.science/SingleCellViz/
![]()
Collaborations
Réseaux

Le 3 avril dernier, les équipes de recherche dirigées par les Drs Daniel Metzger et Gilles Laverny ont reçu un chèque de 10 000 € pour faire avancer…
Lire la suite
Le
12/092025
Daniel Metzger
Post-doctorants
Doctorants
Médecine/Sciences ; Volume: 41 ; Page: 154-159
Cell Death and Disease ; Volume: 16 ; Page: 46
British Journal of Pharmacology ; Page: Online ahead of print
Nature Communications ; Volume: 15 ; Page: 3563
International Journal of Molecular Sciences ; Volume: 25
Rheumatology
Frontiers in Nutrition ; Volume: 11
Nutrients ; Volume: 16
Biomolecules ; Volume: 14 ; Page: 551
Steroids ; Volume: 199 ; Page: 109306
Page 1 sur 21